Op de Spierziektedag van Spierziekten Nederland op 27 september was een speciaal programma rondom de ziekte myotone dystrofie type 1. Daar praatte arts-onderzoeker Joost Kools bezoekers bij over vergevorderd onderzoek naar misschien wel het eerste medicijn dat MD kan afremmen. Dat medicijn lijkt dichtbij, maar dat is het niet.

Joost Kools doet in Radboudumc onderzoek met MD-patiënten. In twee verschillende studies testen zij twee medicijnen die op vergelijkbare wijze de schade van MD hopelijk kunnen afremmen en misschien zelfs deels terugdraaien. Genezen doen de middelen niet: als ze goed genoeg blijken te werken, moeten patiënten ze levenslang elke paar weken per infuus krijgen toegediend.
De eerste twee bochten genomen
Kools krijgt veel vragen over hoe lang het nog duurt voordat er een medicijn is. In zijn presentatie op het spierziektecongres gaf hij antwoord. Hij pakte het heldere plaatje van het Spierfonds erbij. Dat brengt het traject van medicijnonderzoek in beeld alsof mensen een berg beklimmen via haarspeldbochten. ‘Het duurt twaalf tot vijftien jaar voordat een medicijn de top bereikt: dat wil zeggen dat artsen het kunnen voorschrijven aan patiënten, vergoed door de zorgverzekering.’
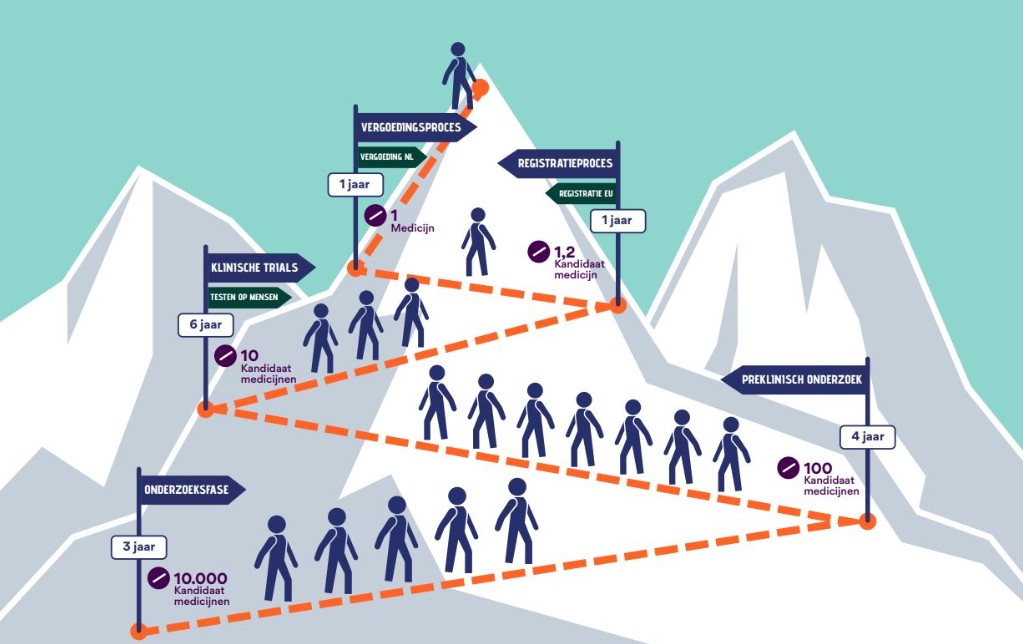
Je ziet op het plaatje een pad met scherpe bochten. Voor elke bocht vallen er een hoop medicijnen af: ze komen niet door de test die ze moeten afleggen. Kools: ‘Voor MD hebben enkele medicijnen de eerste twee bochten genomen. We doen nu klinisch onderzoek naar twee ervan, waarbij patiënten ze testen.’
Niet te vroeg juichen
Als MD-gemeenschap willen we het liefst horen dat we er nu bijna zijn. Kools drukt ons op het hart niet te vroeg te juichen. Hij zoomt in op het pad van de klinische tests. ‘Dat pad duurt zo’n zes jaar. In fase één testen tien tot twintig gezonde proefpersonen korte tijd of het medicijn veilig is. In fase twee proberen twintig tot honderd patiënten twee tot drie jaar of het medicijn de aandoening tegengaat. Verschillende groepen krijgen verschillende doseringen, om te kijken welke dosis het beste werkt zonder te veel bijwerkingen te veroorzaken.’ Bij zeldzame ziekten zoals MD worden fase een en twee gecombineerd en testen de deelnemers eerst een maand de veiligheid van het medicijn.
We zijn in het laatste stukje van dit pad….
Met het medicijn Del-desiran zijn we in het laatste stukje van dit pad aangekomen: fase drie. Meer dan honderd patiënten wereldwijd testen de optimaal gebleken dosering van het medicijn, of een placebo. Ook Dyne-101 is bijna zover. Ergens volgend jaar kan bekend worden of deze medicijnen, of een ervan, goed genoeg werken om de volgende bocht op het bergpad te nemen.
..Maar dan moeten we nog twee bochten nemen
Als dat gebeurt, vertelt Kools, start het registratieproces. De Europese Unie moet het medicijn goedkeuren (registreren) voordat het mag worden aangeboden in de lidstaten. Daarna beslist de fabrikant in welk land hij een marktaanvraag doet. Het indienen van de aanvraag kan wel een jaar duren. Kools: ‘Daarna begint in elk land een vergoedingsproces.’ Soms adviseert het Zorginstituut Nederland de overheid prijsonderhandelingen te voeren met de fabrikant. De fabrikant van het medicijn wil graag zijn hoge ontwikkelkosten terugverdienen, dus zet in op een hoge prijs. De andere onderhandelaars willen die prijs juist naar beneden hebben om de zorg betaalbaar te houden. Zie ook de pagina Beschikbaarheid en vergoeding op spierziekten.nl
In Nederland duurt het vergoedingsproces lang
Kools: ‘Per land verschilt het hoe lang dit proces duurt. In Nederland gaat het relatief traag. Het kan dus gebeuren dat het medicijn in Duitsland en België sneller beschikbaar komt dan in Nederland.’ Volgens het bergplaatje duurt het ongeveer een jaar, maar het kan variëren. Het kan zelfs gebeuren dat de onderhandelingen stranden, dan wordt het medicijn niet vergoed door de ziektekostenverzekeraar. Kools: ‘Patiëntorganisaties zoals Spierziekten Nederland zijn met de overheid en andere partijen in gesprek om dit proces zo snel en soepel mogelijk te laten verlopen.’
Het wordt een duur medicijn
Iemand uit de zaal vraagt: ‘Wordt het een erg duur medicijn? Komt er een vervelende discussie over geld?’ Kools: ‘De farmaceut doet nog geen uitspraken over de prijs. Maar alleen al omdat het geen gemakkelijk in te nemen pil wordt, maar een vloeistof die gekoeld bewaard moet worden en per infuus moet worden toegediend, zal het zeker geen goedkoop medicijn worden.’
En hoeveel verschil zal het maken?
Kortom, we zijn er echt nog niet. Daarnaast moeten we oppassen met onze hoop dat een medicijn dat al zó ver is gekomen op het bergpad, ook echt veel verschil kan maken. ‘De fabrikant let bij het onderzoek vooral op een afname van de myotonie. Dat lijkt in voorlopige resultaten enigszins te gebeuren in twaalf weken tijd.’ Andere (lichte) verbeteringen die in eerdere stadia zijn aangetoond, laten langer op zich wachten en zijn moeilijker te meten. Het gaat om dingen als toename in spierkracht en energieniveau, en afname van vermoeidheid. Kools en zijn collega’s proberen de fabrikanten van MD-medicijnen ervan te overtuigen myotonie niet als hoofd-uitkomstmaat te nemen in fase-drie-onderzoeken. Het is immers vaak niet de belangrijkste klacht van MD.
Stamceltherapie: hoop er niet op
Kools krijgt tijdens zijn contact met MD-patiënten ook vaak vragen over een andere methode om MD tegen te gaan: stamceltherapie of CRISPR-Cas. Dat klinkt inderdaad heel mooi: je haalt dan in iemands genen de afwijking weg die de ziekte veroorzaakt. Dan ben je er echt van af. Kools helpt ons uit de droom: ‘Dit is heel ingewikkeld. Het lukt in bijvoorbeeld een oog, maar niet in een heel menselijk lichaam.’ Het is ook heel definitief: als de behandeling maar een deel van de cellen bereikt of als er iets fout zou gaan – een verkeerde aanpassing in het genoom, een vreselijke bijwerking – kun je het niet meer terugdraaien of een nieuwe poging doen. ‘Dan stoot onze afweer de behandeling af.’ Kools drukt ons op het hart: ‘Deze behandeling komt er voorlopig echt niet voor MD.’
Wat we zelf kunnen doen in de strijd tegen MD
Ik heb zo mijn eigen gedachten over alle ontwikkelingen rondom het medicijn waarop we allemaal hopen. Het zou misschien goed zijn als we ons als MD-gemeenschap iets minder richten op redding door een medicijn. Het is echt nog niet zo ver. Ik denk dat er rondom de diagnose MD, en misschien nog wel veel meer erfelijke ziekten, meer aandacht nodig is voor het opsporen en informeren van familieleden. Misschien zijn er ooms en tantes of (achter)neven en -nichten met wie je helemaal geen contact hebt. Zij kunnen ook met MD te maken hebben, misschien zonder dat ze het weten. Mogelijk zijn er mensen bij die nog kinderen zullen krijgen. Die kinderen kunnen de aandoening in ernstigere vorm erven.
Wij kunnen anderen helpen hun jarenlange vage en nare klachten eerder te begrijpen. Dat helpt hen, en het maakt de kans kleiner dat toekomstige kinderen in jouw familie de jeugdvorm van MD krijgen. Daarover schreef ik dit artikel.
Ik schrijf artikelen over MD omdat de aandoening in mijn familie is vastgesteld. Zie mijn webpagina MD-dossier.

