Er gloort hoop voor mensen met myotone dystrofie type 1 (MD). Nederlandse MD’ers testen twee geneesmiddelen. Moleculair celbioloog Rick Wansink legt uit wat die middelen precies doen. ‘De resultaten tot nu toe zijn indrukwekkend. Het is afwachten hoeveel MD’ers eraan hebben in hun leven.’
Op dit moment zijn er veelbelovende medicijnen in ontwikkeling tegen MD type 1. Dat betekent helaas nog geen snelle oplossing voor MD. Want: als deze medicijnen inderdaad goed werken, zijn ze waarschijnlijk op zijn vroegst in 2030 beschikbaar voor Nederlandse MD’ers. Enkele tientallen mensen met MD kunnen twee van deze middelen al eerder gebruiken: zij doen mee aan het klinische onderzoek naar de medicijnen DYNE-101 en Del-desiran.

Moleculair celbioloog Rick Wansink werkt bij de afdeling waar ruim 30 jaar geleden de erfelijke oorzaak van MD werd ontdekt: Medical BioSciences van het Radboudumc. Zelf doet hij sinds 1999 onderzoek naar MD. Met zijn hulp probeer ik zo goed mogelijk op te schrijven wat MD nu precies doet in je lichaam en wat die twee medicijnen daartegen doen. Het is een lang verhaal geworden en er zit veel biologie in. Is dat niet jouw ding, begrijp je niet alles en wil je dat toch graag? Mail mij dan gerust of reageer onder dit artikel.
MD begint met een foutje in het erfelijk materiaal
Op veel websites kun je lezen dat MD type 1 wordt veroorzaakt door een afwijking in het erfelijk materiaal. Om precies te zijn door een fout in het DMPK-gen op chromosoom 19. DMPK staat voor dystrophia myotonica protein kinase. Dat is een eiwit: een stof waarvan je lichaam er vele duizenden verschillende maakt. Ze hebben allemaal hun eigen taak. Samen zorgen ze dat je cellen en je organen doen wat ze moeten doen. Maar door die ene fout in dit ene gen, gaat er van alles mis.
In elke cel van je lichaam zit precies hetzelfde erfelijke materiaal. Keurig opgerold in elke celkern. Maar elke cel gebruikt die opgerolde strengen DNA maar gedeeltelijk. Zo gebeurt er in een cel in je wijsvinger helemaal niets met het gen voor oogkleur. Alleen in de iris van je oog gebruiken bepaalde mini-machientjes dat gen als sjabloon. Met dat sjabloon kan die cel de kleurstof maken die jou bruine of groene ogen geeft. Ergens anders, in je speekselklieren, staan de genen voor ‘speeksel maken’ aan. In elke cel van ons lichaam ‘weten’ die mini-machientjes welke stukjes erfelijk materiaal ze moeten aanspreken en welke niet.
Dat foutje leidt tot problemen in spieren, hart en hersenen
In cellen waar het DMPK-gen met rust gelaten wordt, ontstaan de problemen van MD niet. Helaas komt het gen in veel cellen wél ‘tot expressie’ zoals dat heet. Dan wordt er het eiwit DMPK mee gemaakt. Als je MD kent, kun je wel raden waar dat gebeurt. Namelijk daar waar de problemen van MD zitten. In spier-, hart- en hersencellen dus. In je darmen zitten ook veel spieren om je voedsel te kneden. Dus helaas, daar ook.
Wat doet dat eiwit DMPK eigenlijk? Het plakt een klein herkenningsteken op andere eiwitten. Een soort vlaggetje. Het speelt een rol bij communicatie binnen cellen. Mensen met MD maken gewoon DMPK, hooguit iets minder dan anderen, volgens Wansink. Dat is dus niet het probleem. Wat gaat er dan wel fout bij mensen met MD? In het DMPK-gen zit een stukje dat bij niet-MD’ers bestaat uit hooguit enkele tientallen herhalingen van de drie ‘DNA-letters’ CTG. Bij MD herhalen die drie letters zich vaker dan anders, wel honderden of duizenden keren. Dat veroorzaakt twee problemen.
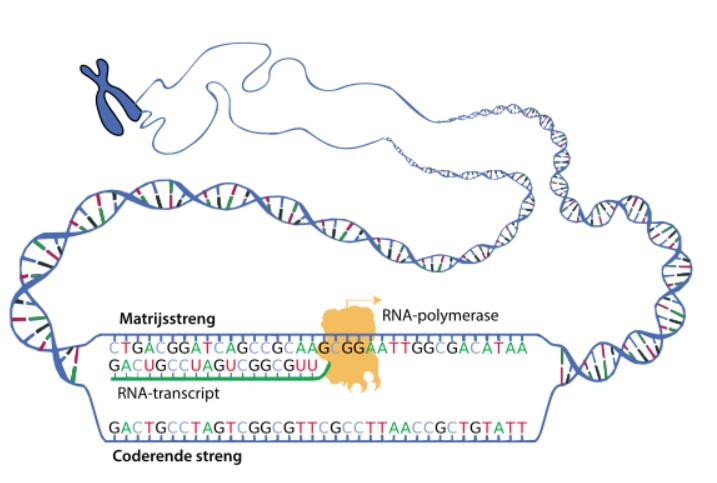
Probleem 1: giftig RNA
Het eerste probleem noemt Wansink ‘giftig RNA’. Als de minimachientjes in de celkern het DNA-sjabloon voor bijvoorbeeld bruine ogen gebruiken, maken ze er eerst een kopietje van. Dat kopietje is net wat anders dan DNA, maar het lijkt er wel veel op. Het is RNA. Dat kopietje vormt een slingertje dat de celkern verlaat en naar een minifabriek elders in de cel gaat. Daar gebruiken andere machientjes het RNA als sjabloon. Maar dan om een soort kralenketting te maken: een eiwit. De kleurstof voor bruine ogen bijvoorbeeld. Of DMPK.
Met het RNA-slingertje dat het sjabloon is voor de stof DMPK is bij MD iets mis. Er zit een lange lus in die er niet hoort. Die komt erin door dat CTG-stukje dat zich te vaak herhaalt in het DNA-sjabloon. In RNA wordt het CTG uit DNA altijd vertaald als CUG. Die lus bestaat dus uit de vaak herhaalde code CUG, vaak honderden tot duizenden keren. Het minimachientje kan er niets aan doen: het kopieert dat foute stukje gewoon mee. De CUG-lus die daarmee in het RNA ontstaat is een probleem: hij is plakkerig. In de celkern plakken er andere moleculen aan vast. Wansink: ‘Het gaat klonteren aan belangrijke eiwitten.’ Hoe langer het CTG-stukje is, hoe langer de lus en hoe meer geklonter.
Dat klinkt best eng. Wat zou dat geklonter betekenen in het lichaam van iemand met MD? Wansink: ‘Daarover lopen de meningen een beetje uiteen in het onderzoeksveld. Het klonteren zou kunnen leiden tot een bepaalde stress in de cel of tot energieverlies dat MD’ers problemen bezorgt. Ik denk het eerlijk gezegd niet, maar collega’s denken van wel.’
Probleem 2: machientjes in de war gebracht
Een ding is wel zeker: het klonteren rondom RNA zorgt sowieso nog op een andere manier voor de problemen die MD’ers hebben met hun spieren, hart en hersenen. Om dat te begrijpen, kijken we wat er verder gebeurt in de celkern.
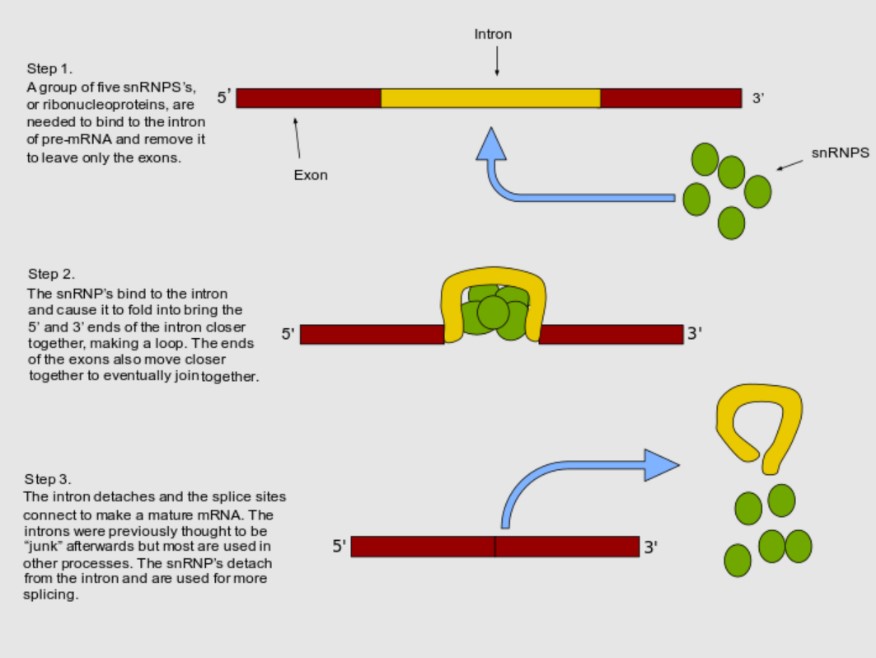
Er wandelen machientjes langs stukjes DNA (genen) om ze te gebruiken als sjabloon om een kopie in de vorm van RNA te maken. In een DNA-sjabloon of gen zitten altijd stukjes DNA die niet mee moeten in het RNA-kopie dat de celkern verlaat. Stukjes die coderen voor ‘let op, hier begint het gen’ en ‘hier eindigt het, stop met kopiëren AUB’. Als machientjes de eerste versie van de RNA-kopie hebben gemaakt, komen er andere machientjes. Die zorgen voor zogeheten splicing of splitsing. Ze heten splicing-eiwitten en ze knippen heel precies de stukjes uit het RNA die niet mee naar buiten moeten. De stukjes die wel moeten blijven, plakken ze weer aan elkaar. Dan pas is het RNA klaar om de celkern te verlaten.
Splicing-eiwitten klonteren en doen hun werk niet meer
‘MD is eigenlijk een splicing-ziekte’, zegt Wansink. De eiwitten die aan de CUG-lus klonteren, zijn splicing-eiwitten. Ze raken daardoor van slag. Ze gaan fouten maken bij het splicen van andere RNA-moleculen die ze moeten knippen.’ Hoe langer de lus, hoe vaker een splicing eiwit in de war raakt en hoe minder vaak het toch goed gaat, vermoedt Wansink. ‘Van tientallen andere genen dan DMPK, worden daardoor verkeerde RNA-kopieën gemaakt bij mensen met MD.’
En dát veroorzaakt de bekende MD-problemen, zegt Wansink. ‘Daardoor maken mensen met MD te weinig normale chloridekanaal-eiwitten aan die nodig zijn om hun spieren samen te trekken en te ontspannen. En abnormaal tau-eiwit in hun brein, en te weinig normale calciumkanalen in hun hart.’ Kortom: die lange lus in het DMPK-gen zorgt voor een totale verstoring van de normale eiwithuishouding in organen.
En nu de oplossing
Het is daarom zaak om die giftige RNA-lus te verwijderen zodat de splicing-machientjes weer hun normale werk kunnen doen. Dat is precies wat de twee medicijnen doen die Nederlandse MD’ers nu (gaan) testen. Ze doen dat op twee verschillende manieren.
1. Dyne-101: Plakt aan giftig RNA en knipt het kapot
Het middel Dyne-101 wordt nu getest op een kleine groep MD’ers om te kijken of het werkt. Verschillende groepjes mensen met MD krijgen elk een andere dosis om te kijken welke dosis het beste werkt zonder te veel bijwerkingen. Daar schreef ik eerder dit artikel over.
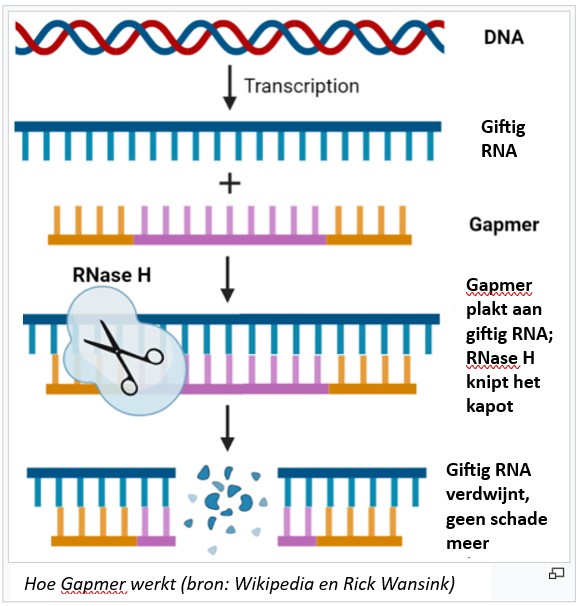
Dyne-101 werkt met gapmer-plakkertjes. Die zijn opgebouwd uit DNA- en RNA-stukjes die onderzoekers zelf hebben gebouwd. De plakkertjes passen precies op het giftige DMPK-RNA. Daar plakken ze aan vast. De cel ziet dat er hier iets geks gebeurt en een knipmachientje knipt het DMPK-RNA vervolgens kapot. Daarmee is het onschadelijk gemaakt. Het plakkertje kan vervolgens weer op zoek naar een nieuw giftig DMPK-RNA om af te breken.
Het kan overigens ook gebeuren dat een gapmer per ongeluk aan een ander RNA-stukje plakt, dat niets met MD te maken heeft. Het kan nooit 100 procent goed gaan. Ook kan een gapmer vermoedelijk nooit echt al het giftige RNA onschadelijk maken. In de celkern waar het krioelt van DNA, RNA en al die minimachientjes is dat onwaarschijnlijk. Maar de methode met de gapmer werkt en wordt in Amerika al gebruikt bij andere ziekten. Bijvoorbeeld bij mensen met een erfelijke aanleg voor een heel hoog cholesterolgehalte. Ook in Nederland worden gapmers sinds kort toegepast.
Geen DMPK-eiwit is niet erg
Wansink deed onderzoek naar de vraag of het erg is als al het DMPK-RNA door plakkertjes is afgebroken en je dus helemaal geen DMPK eiwit aanmaakt. Het lijkt erop dat we die stof best kunnen missen. ‘Het is nooit in mensen getest, maar wel in muizen.’ Onderzoekers kunnen zogeheten knock-out-muizen creëren: muizen waarbij een bepaald gen gewoonweg is uitgeschakeld. Wansink: ‘Andere stoffen lijken de functie van DMPK over te nemen.’ De onderzoeker is er vrij gerust op: ‘Het probleem van het giftige RNA vanuit het DMPK-gen is veel groter dan het missen van DMPK eiwit.’
2. Del-desiran: een ander soort plakkertje dat giftig RNA kapot laat gaan
Met het middel Del-desiran zijn onderzoekers al een stap verder dan met Dyne-101. De dosis die het beste lijkt te werken is al uitgezocht: verschillende groepen MD’ers hebben verschillende doses getest. Nu gaat een grotere groep MD’ers testen hoe het gaat als je het middel langere tijd gebruikt.
Het middel bestaat uit een stukje RNA dat onderzoekers zelf hebben gemaakt: small interfering RNA. Het werkt net iets anders dan een gapmer. Het is niet plakkerig, omdat het twee plakkerige strengen zijn die op elkaar plakken. En zo dus als twee stukjes plakband elkaars plakkerige deel afplakken. De cel maakt er zelf een plakkertje van dat precies past op het giftige DMPK-RNA.
Het is wonderlijk hoe het allemaal mogelijk is in die piepkleine celkern. Waar het krioelt van het DNA en RNA en ontelbaar veel machientjes die daar van alles mee doen. Maar het plakkertje vindt daar vaak het stukje giftige RNA dat MD veroorzaakt. Het plakt eraan vast. Dan herkent de cel het als abnormaal en zorgt dat het, nog steeds in de celkern, wordt afgebroken. Wansink: ‘Deze manier om in te grijpen met zelfgemaakt RNA kreeg in 2006 de Nobelprijs.’
3. Plakkertjes die alleen het klonteren tegengaan
Er werken ook onderzoekers aan een derde methode om MD te lijf te gaan. Wansink: ‘Dat is ook een plakkertje, het lijkt op de gapmer van de eerste manier. Maar deze breekt het RNA niet af. Het zit er gewoon stevig op en het blokkeert de lus.’ Het dekt eigenlijk het plakkerige deel van het giftige RNA af. Daarmee voorkomt het die klontering en daarmee de MD-problemen. De splicing-eiwitten kunnen nu gewoon hun werk doen. Welke van de drie methoden het beste zal werken, durft Wansink niet te voorspellen. ‘De tijd zal het leren.’
Onzeker hoeveel je opknapt van zo’n medicijn
Geweldig wat er allemaal kan en lukt. De hamvraag blijft wel: hoeveel knappen mensen met MD op als ze zo’n RNA-medicijn krijgen? Dat is een moeilijke vraag, ook voor Wansink. ‘Ik ben een simpele celbioloog. Ik kan in het laboratorium goed te controleren experimenten doen. Daarbij vergeleken is het lichaam zó ingewikkeld. Wat de fabrikanten laten zien aan resultaten in muizen en mensen is indrukwekkend. In muizen verdwijnt de myotonie zelfs helemaal.’ Maar myotonie is niet zo’n groot probleem voor MD’ers. Dat zijn eerder hun zwakke spieren, darm- en hartproblemen, vermoeidheid en verminderd initiatief.
Het echte resultaat in het leven van MD’ers hangt er volgens Wansink van af of en hoe snel het lichaam de verschillende problemen van MD kan herstellen. Dus hoe snel de cellen kunnen zorgen voor goed werkende chloridekanalen in de spieren, goede calciumkanalen in het hart en normaal tau-eiwit in het brein. ‘Cellen vernieuwen vrij vaak hun chloridekanalen. Dus je zou verwachten dat er voor de spieren redelijk snel aanzienlijke verbeteringen mogelijk is. Maar in de hersenen gaat de vervanging en vernieuwing heel traag.’
Frustrerend dat het allemaal zo lang duurt
Of de medicijnen de ziekte tot stilstand kunnen brengen of (deels) kunnen terugdraaien, moet blijken uit het onderzoek bij MD’ers. ‘Het is echt afwachten hoeveel patiënten eraan hebben in hun leven.’ Het zou daarbij belangrijk kunnen zijn dat MD’ers zo vroeg mogelijk in hun leven beginnen met een medicijn, wanneer er nog zo weinig mogelijk beschadigd is.
‘Onze onderzoeksgroep liet al in 2009 zien dat de RNA-plakkertjes werken in muizen’
Maar eerst moeten we afwachten of de middelen überhaupt goed genoeg werken in de tests. Daarna moeten ze nog vergoed worden door de Nederlandse zorgverzekeringen. Wansink: het is frustrerend dat het allemaal zo lang duurt. Zeker als je bedenkt dat onze onderzoeksgroep al in 2009 samen met Amerikaanse onderzoekers liet zien dat de RNA-plakkertjes werken in cellen en in muizen.’
Een giftige stof weghalen is moeilijk
Onvoorstelbaar eigenlijk, dat een medicijn zo precies kan ingrijpen in wat er gebeurt in een cel. Het lastige bij MD, legt Wansink uit, is dat je een giftige stof wilt weghalen die het lichaam op heel veel plekken aanmaakt. ‘Dat maakt MD ingewikkelder dan een ziekte waarbij het lichaam juist een stof mist. Bij een ziekte als Duchenne bijvoorbeeld, missen mensen het eiwit dystrofine. Het is nog steeds moeilijk in de praktijk, maar het is in theorie makkelijker om een stof een klein beetje toe te dienen in het lichaam (Duchenne) dan om een giftige stof volledig te verwijderen uit het lichaam (MD).’
Hoe de medicijnen in de cel(kern) komen
Toch lijkt het te lukken. De twee medicijnen die MD’ers nu testen, komen in celkernen terecht. Hoe dat kan? Het komt erop neer dat de stof die MD’ers nodig hebben door een bepaald poortje de cel en de celkern in kan komen. Om elke cel en ook om de celkern zit een vliesje: een membraan. Daar zitten allerlei poortjes in die bepaalde stoffen naar binnen en naar buiten laten. Een poortje waarmee de cel ijzer naar binnen laat komen is ook de toegangspoort voor de medicijnen.
MD’ers die meedoen aan de onderzoeken krijgen de medicijnen via een infuus in hun bloed toegediend. Van daaruit vindt het medicijn de weg naar cellen en celkernen via die ijzerpoortjes. Hopelijk zelfs naar de hersenen, dat is extra moeilijk. Elke paar weken krijgen MD’ers een nieuwe dosis van het medicijn. Dat moet levenslang gebeuren, want cellen blijven het giftige RNA maken. Medicijnen moeten het steeds weer onschadelijk maken.
Ooit kan het misschien in één keer
Wansink en collega’s werken ook aan een methode om de erfelijke code (het DNA zelf) te veranderen. Als het lukt de te vaak herhaalde CTG-combinatie daar simpelweg te verwijderen, ben je in één keer klaar. Dit knutselen aan erfelijke code kan al, met de methode CRISPR-cas.
‘Ik heb voorlopig meer vertrouwen in de edicijnen die MD’ers nu aan het testen zijn’
Wansink: ‘Het lukt nu nog niet veilig genoeg. En als het verkeerd gaat in het lichaam van een patiënt, kun je het niet meer terugdraaien. Daarom heb ik voorlopig meer vertrouwen in de medicijnen die MD’ers nu aan het testen zijn. Mochten die middelen na langere tijd problemen geven, dan kunnen mensen ermee stoppen. Dan verdwijnen die bijwerkingen hopelijk weer.’ Er werken wereldwijd duizenden onderzoekers aan CRISPR-cas. Wansink: ‘Ik wacht tot de methode slimmer en preciezer wordt, dan kan het voor MD’ers interessant worden.’
Ik schrijf artikelen over MD omdat de aandoening in mijn familie is vastgesteld.
> Lees meer over het onderzoek naar Dyne-101: Het eerste onderzoek in Nederland naar een mogelijk MD-medicijn is in volle gang
> Lees meer over het onderzoek naar Del-desiran: Binnenkort: nieuw patiëntonderzoek in Nederland naar vergevorderd MD-medicijn
> Lees meer over MD op md.nl.

